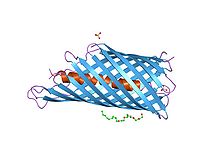
Domaine autotransporteur
| Pfam | PF03797 |
|---|---|
| InterPro | IPR005546 |
| PROSITE | PDOC51208 |
| SCOP | 1uyn |
| SUPERFAMILY | 1uyn |
| TCDB | 1.B.12 |
| Famille OPM | 28 |
| Protéine OPM | 1uyo |
Un domaine autotransporteur est un type de domaine protéique de certaines protéines membranaires présentes dans la membrane externe de bactéries à Gram négatif. Ce domaine se trouve toujours à l'extrémité C-terminale de la protéine et forme une structure en tonneau β. Ce tonneau est orienté dans la membrane de telle façon que le domaine N-terminal de la protéine, appelé domaine passager, se trouve à la surface de la cellule. Ces protéines sont généralement des facteurs de virulence intervenant dans l'infection par des bactéries pathogènes. Le terme « autotransporteur » provient du fait que ce domaine permettrait aux protéines de traverser la membrane externe, conception cependant nuancée par certains auteurs[1].
La sécrétion de chaînes polypeptidiques à travers la membrane externe des bactéries à Gram-négatif peut résulter de différents processus. Le mode de sécrétion de type V(a), ou autotransporteur, et celui assurant la sécrétion du plus grand nombre de facteurs de virulence parmi les sept types de sécrétion connus chez les bactéries à Gram négatif. L'exemple type de ce mode de sécrétion est celui de la peptidase IgA1 de Neisseria gonorrhoeae[2]. La protéine est dirigée vers la membrane interne par un peptide signal transporté à travers la membrane interne par le système de sécrétion. Une fois dans le périplasme, le domaine autotransporteur s'insère dans la membrane externe. On pense que le domaine passager traverse le domaine autotransporteur afin de se retrouver du côté extérieur de la cellule, mais le mécanisme qui sous-tend ce processus demeure obscur[3].
Le domaine passager, qui occupe la partie N-terminale de la protéine, subit une translocation à travers la membrane externe, et peut éventuellement être clivée du domaine autotransporteur[4]. Dans les protéines pour lesquelles le clivage est autocatalysé, le domaine peptidase appartient aux familles MEROPS S6 et S8. Les domaines passagers dont la structure a été caractérisée sont essentiellement formés d'hélices β, dont l'exemple typique est fourni par la pertactine. On pense que le repliement de ce domaine est intrinsèquement lié à son mode de translocation à travers la membrane externe.
Notes et références[modifier | modifier le code]
- (en) Inga Benz et M. Alexander Schmidt, « Structures and functions of autotransporter proteins in microbial pathogens », International Journal of Medical Microbiology, vol. 301, no 6, , p. 461-468 (PMID 21616712, DOI 10.1016/j.ijmm.2011.03.003, lire en ligne)
- (en) Johannes Pohlner, Roman Halter, Konrad Beyreuther et Thomas F. Meyer, « Gene structure and extracellular secretion of Neisseria gonorrhoeae IgA protease », Nature, vol. 325, no 6103, , p. 458-462 (PMID 3027577, DOI 10.1038/325458a0, lire en ligne)
- (en) Jack C. Leo, Iwan Grin et Dirk Linke, « Type V secretion: mechanism(s) of autotransport through the bacterial outer membrane », Philosophical Transactions of the Royal Society B, vol. 367, no 1592, , p. 1088-1101 (PMID 22411980, PMCID 3297439, DOI 10.1098/rstb.2011.0208, lire en ligne)